美國 FDA 允許擴大使用百時美施貴寶細胞療法 Abecma 治療血癌

【美南新聞泉深】美國食品和藥物管理局(FDA)周五允許使用百時美施貴寶 (Bristol-Myers Squibb)公司和2seventy Bio 公司的細胞療法Abecma 治療受影響較輕的血癌患者。
這一決定是在專家顧問小組投票支持使用 Abecma 作爲多發性骨髓瘤(一種影響老年人的常見癌症)的早期治療方法之後做出的。 該細胞療法已在美國獲得批准,用于治療先前接受過四種或更多療法的多發性骨髓瘤患者。
衛生監管機構還在審查治療癌症的其它細胞療法,爲強生公司和其合作夥伴傳奇生物技術(Legend Biotech)的細胞療法 Carvykti 打開了新選項卡,該療法用于治療受影響較輕的患者。 FDA 于 4 月 5 日做出決定。
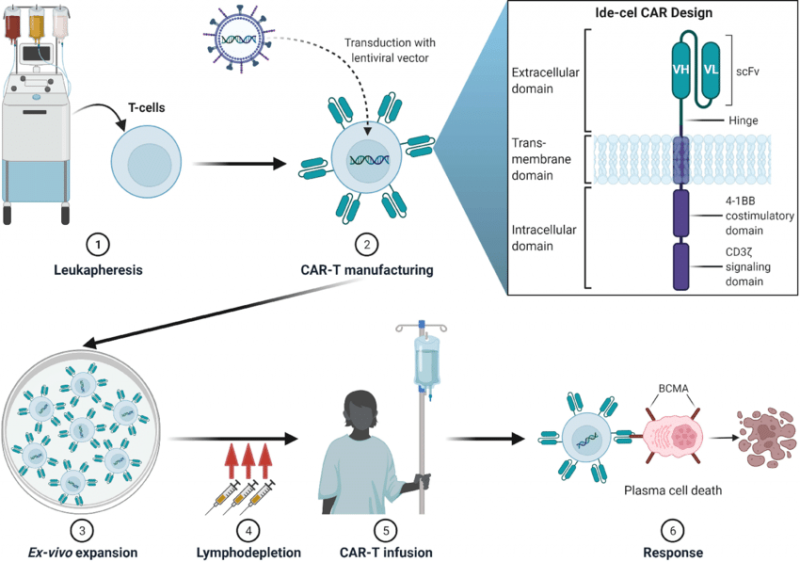
Abecma 和 Carvykti 屬于一類稱爲嵌合抗原受體 (CAR) T 細胞療法,簡稱CAR-T 療法,通過修改稱爲 T 細胞的淋巴細胞來攻擊癌細胞。
百時美施貴寶的申請包括後期數據,顯示 Abecma 有助于將癌症複發或對至少兩種先前治療不再有反應的患者疾病進展前的時間平均延長 13.3 個月。 相比之下,接受標准護理的試驗患者的無進展生存期爲 4.4 個月。
根據 LSEG 數據,分析師預計 2024 年 Abecma 的銷售額將達到 6.01 億美元。
目前的血癌護理標准包括對受影響較輕的患者使用非 CAR-T 療法或其它方案,批准治療這種疾病的藥物包括強生公司的達雷木單抗(Darzalex)和非專利抗癌藥物,如泊馬度胺(pomalidomide)和硼替佐米(bortezomib)。
最近,CAR-T 療法因繼發性癌症的風險而受到衛生監管機構的審查,這種經過基因工程改建後的T淋巴細胞癌變風險較高。 今年早些時候,《自然醫學》雜志在報告治療後出現 T 細胞淋巴瘤後,在CAR-T 療法的處方信息中添加了安全警告。
泉深微信號:Lionchu888






























